薛鹏副教授课题组在肿瘤医学领域取得重要进展
近日,材料与能源学院薛鹏副教授课题组在国际生物材料领域顶级期刊 《Biomaterials》(IF: 10.237)在线发表题目为“Light-activated oxygen self-supplied starving therapy in near-infrared (NIR) window and adjuvant hyperthermia-induced tumor ablation with an augmented sensitivity”(近红外光触发的自供氧饥饿疗法合并敏感增强型热疗用于肿瘤的联合治疗)的最新研究工作。西南大学为该成果的唯一通讯单位,2018级硕士研究生任俊洁为第一作者,薛鹏副教授为唯一通讯作者。
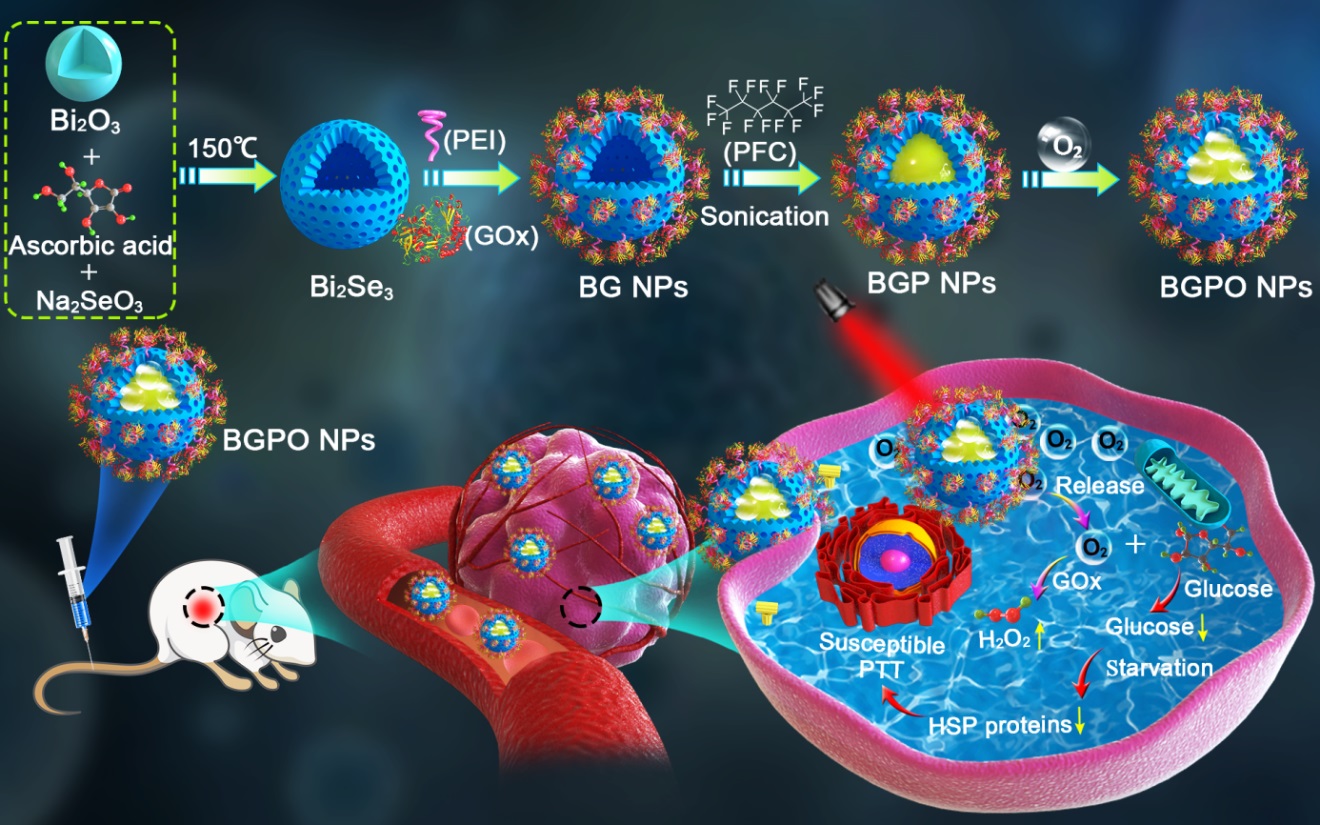
与正常细胞相比,肿瘤细胞更加过度依赖葡萄糖介导的能量供应,因此通过降低肿瘤区域的葡萄糖水平,可以有效抑制向肿瘤细胞的能量输送,从而实现对肿瘤的“饥饿治疗”。葡萄糖氧化酶(GOx)可以有效地消耗肿瘤组织内葡萄糖,但其效率往往受限于肿瘤组织乏氧微环境,酶自身稳定性不足以及缺乏有效的辅助治疗手段。因此,亟待开发一类高效的诊疗平台用于逆转肿瘤局部乏氧环境并同时提高GOx的酶活性。另一方面 ,光热治疗被证明可以有效实现近红外光诱发的肿瘤消融,但局部光热会上调细胞内的热激蛋白(HSP)表达,并启动细胞自卫机制,从而降低了光热治疗的预期疗效。
针对上述问题,本研究中合成了一类基于空心介孔Bi2Se3的多功能纳米反应器,在其表面负载含氧全氟化碳(PFC)和表面修饰GOx,用于近红外光触发的自供氧饥饿疗法合并敏感增强型热疗用于肿瘤的联合治疗。该载体负载的全氟化碳可以有效地将氧气递送至肿瘤区域,改善局部缺氧环境。此外,相比于游离酶,负载的GOx展现了更高的催化活性,并显著提高了肿瘤区域的葡萄糖消耗。由GOx介导的肿瘤饥饿疗法可抑制三磷酸腺苷(ATP)的产生,并进一步下调HSP的表达,从而降低了细胞的耐热性。在近红外光照射时,局部光热可同时加速氧气的释放和并诱发敏感增强型光热治疗。体内和体外实验表明,这类纳米反应器具有良好的生物安全性,并可以同时放大饥饿治疗和光热治疗疗效。综上所述,本研究提出的协同治疗模式将为未来智能型纳米诊疗平台的设计和开发提供新思路。
该研究得到了国家自然科学基金和重庆市技术创新与应用示范项目的资助。薛鹏副教授课题组长期致力于低维无机纳米材料的设计和开发,并致力于其在生物医学领域的应用。近两年,以通讯作者先后在《Theranostics》, 《Nano-Micro Letters》,《Applied Materials Today》,《ACS Applied Materials & Interfaces》, 《Nanoscale》等期刊上发表多篇该领域相关工作。
该论文下载链接:
https://www.sciencedirect.com/science/article/pii/S014296122030017X
